 |
1) INTRODUCTION
La pénétration dans le milieu sous-marin entraîne le plongeur dans un monde nouveau où s'appliquent des lois physiques particulières. Sans vouloir se transformer en "Einstein palmé", il est indispensable de s'initier aux règles principales qui régissent le monde subaquatique.
C'est en flottant dans sa baignoire qu'Archimède (287 à 212 av. J.C.) a démontré qu'un corps n'a pas le même poids dans l'air et dans un liquide.
2) DÉFINITION
Cette règle célèbre dit exactement :
|
TOUT CORPS PLONGE DANS UN FLUIDE REÇOIT DE LA PART DE CE FLUIDE UNE POUSSÉE VERTICALE, DIRIGE DE BAS EN HAUT, ÉGAL AU POIDS DU VOLUME DU FLUIDE DÉPLACE ET QUI S'APPLIQUE AU CENTRE DE GRAVITE DU CORPS. |
La poussée d'Archimède est facile à calculer.
Exemple : Un plongeur d'un volume de 70 litres, va recevoir une poussée d'Archimède de 70 kg.
Cela vient du fait qu'1 litre d'eau pèse environ 1 kg.
Cette poussée d'Archimède diminue son poids réel dans l'eau de 70 kg.
S'il pèse tout équipé 73 kg, le poids apparent du plongeur sera de 73kg - 70kg = 3kg.
Par conséquent, nous pouvons dire que le poids apparent d'un corps est égal à son poids réel, moins la poussée d'Archimède. les deux forces : poids réel et poussée d'Archimède s'exerce en sens opposé. En pratique, le plongeur ne supporte que son poids apparent, d'où une sensation de légèreté en immersion.
3) NOTION DE FLOTTABILITÉ
La position d'un corps dans un liquide est intimement liée à la poussée d'Archimède. La flottabilité est positive quand le corps remonte, négative quand il coule et reste entre deux eaux lorsqu'elle est nulle.
On peut donc retenir plus simplement : Poids apparent > Poussée Archimède = Corps coule.
Poids apparent = Poussée Archimède = Corps entre deux eaux.
Poids apparent < Poussée Archimède = Corps flotte.
4) ARCHIMÈDE ET LA PLONGÉE.
En surface, la plupart des nageurs présentent une flottabilité positive, voire nulle. Il suffit d'expirer à fond pour commencer à couler. En vidant l'air des poumons, le volume du corps tout entier diminue, donc la poussée d'Archimède aussi. Poids apparent augmente, flottabilité négative, le nageur coule.
Revêtu d'une combinaison, composé de néoprène (caoutchouc et minuscules bulles d'air), le plongeur flotte car celle-ci, augmente la flottabilité. En surface, elle joue un rôle de bouée.
Pour s'immerger, il doit compenser la forte poussée d'Archimède. C'est pourquoi il porte une ceinture de plombs dont le volume est faible, mais le poids important. Cela permet d'augmenter le poids réel du corps en modifiant peu le volume du départ.
Arrivé à une certaine profondeur, le plongeur se sent comme attiré au fond. Cela vient du principe que les micro bulles du néoprène sont écrasées par la pression de l'eau lors de la descente. Ce phénomène justifie l'utilisation du Système de Sécurité Gonflable (gilet ou Stab) afin d'assurer une flottabilité nulle au plongeur. La sensation de confort est alors incomparable.
![]()
1) INTRODUCTION
L'IRLANDAIS Robert BOYLE (1627-1691) et l'abbé Français Edme MARIOTTE (1620-1684) ont mis en évidence la compressibilité des gaz.
Lorsque le plongeur expire de l'air par son détendeur, le gaz s'évacue sous forme de bulles. Ces dernières montent vite vers la surface en grossissent progressivement. L'augmentation du volume des bulles est due à la diminution de la pression ambiante.
2) DÉFINITION
L'énoncé de cette loi physique est la suivante :
|
A TEMPÉRATURE CONSTANTE, LE VOLUME D'UN GAZ EST INVERSEMENT PROPORTIONNEL A LA PRESSION QU'IL SUBIT. |
Il en découle la règle suivante : " Pour une même quantité de gaz, le produit du volume par la pression est toujours égal à lui-même.
Cela veut dire que Pression par le Volume = Constante (P x V = Cte)
En pratique, lorsqu'un gaz subit une pression, son volume diminue et inversement.
Prenons un exemple : un ballon de plastique gonflable est descendu à 40 m de profondeur. On insuffle de l'air comprimé dans ce ballon jusqu'à ce qu'il occupe un volume de 02 litres.
La pression absolue à cette profondeur est de 05 bars. En remontant, celle-ci diminue. Suivant cette loi, le volume du ballon augmente. Arrivé en surface, la pression est 05 fois moindre qu'au départ. Le volume du ballon (s'il n'a pas explosé) aura augmenté dans les mêmes proportions. Il occupe alors : 2 litres X 5 = 10 litres. C'est ce que l'on appelle la détente d'un gaz.
Il est important de constater que dans la formule P x V = Cte, la constante est en fait le nombre de litres d'air détendus à la pression atmosphérique.
Si l'on réalise l'expérience dans le sens inverse, on constate que le volume du ballon diminue avec la profondeur, en raison de l'augmentation de la pression absolue. C'est ce que l'on appelle la compressibilité d'un gaz. (voir schéma ci-dessous).
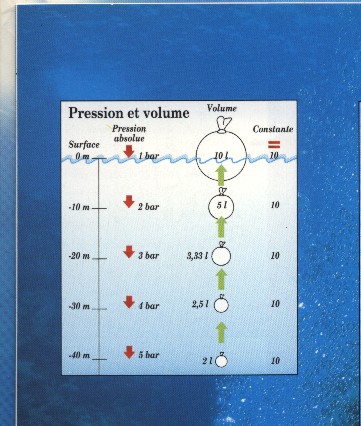
3) BOYLE-MARIOTTE EN PLONGÉE
On trouve de nombreuses applications de la compressibilité des gaz dans le domaine de la plongée.
Le gonflage des bouteilles : On devrait dire la mise en pression de l'air dans les bouteilles. C'est l'air qui est comprimé, le récipient ne change pas de volume. Lorsqu'une bouteille de 12 litres est gonflée à 200 bar, cela signifie qu'il y a 200 fois 12 litres d'air dans la bouteille, soit 2400 litres.
L'autonomie du plongeur : Quelque soit la profondeur ou vous vous trouvez, vos poumons occupent le même volume qu'en surface. Celui-ci est en moyenne de 05 litres. Comme le détendeur nous fournie de l'air à la pression ambiante, la quantité d'air inspiré augmente avec la profondeur.
Par exemple : A 40 m, en application avec la loi de BOYLE -MARIOTTE, il faut 5 fois plus d'air pour remplir le même volume. il n'y aura plus 05 litres d'air dans les poumons, mais 5 x 5 = 25l qui, comprimés, occupent le même volume initial.
On considère qu'un plongeur respire en moyenne en surface 20 l d'air par minute (20l/mn). A 40 m, il consomme 20x5= 100l/mn. Ainsi, il est facile de calculer l'autonomie en plongée. Au départ, la bouteille renferme 2400 l (12l x 200b).
En surface, on dispose d'une autonomie de 120 mn (2400 / 20).
A 20 m, la pression absolue est de 03 bar. La consommation est donc de : 20l x 3b = 60l. L'autonomie est de : 2400/60 = 40mn.
Et ainsi de suite pour chaque profondeur.......
Si vous faîtes les calculs, on se rend compte que l'autonomie d'un plongeur se réduit dans des proportions importantes suivant la profondeur.
La détente de l'air expiré : Lorsque nous remontons, l'air comprimé qui se trouve dans nos poumons se dilate du fait de la diminution de la pression ambiante. Si par mégarde, nous prenons une inspiration importante à 40 m ou autre profondeur et retenons notre respiration jusqu'à la surface, il va se produire le phénomène suivant : Les 5 l d'air dans nos poumons soumis à une pression de 5 b, vont se détendre jusqu'à occuper en surface : 5 x 5 = 25 litres. Si nous n'expirons pas lors de la remontée, nos poumons vont se distendre. C'est la surpression pulmonaire.
![]()
 |
1) INTRODUCTION
John DALTON (1766-1844) a formulé en 1801 la loi d'addition des pressions partielles dans les mélanges gazeux.
Comme pourrait le croire certains, le plongeur ne respire pas de l'oxygène pur, mais de l'air comprimé. L'air n'est pas un corps simple, mais un mélange de différents gaz.
COMPOSITION DE L'AIR :
AZOTE (N2) : 78% environ
OXYGÈNE (O2) : 21% environ
ARGON (AR) : 0,9% environ
GAZ CARBONIQUE (CO2) : 0,03% environ
GAZ RARE : 0,07% environ
En pratique, un gaz envahit tout l'espace qui lui est offert. Mais plus le volume est important et plus la concentration du gaz diminue.
Ce qui nous intéresse en plongée, c'est l'oxygène (O2) et l'azote (N2). pour simplifier nos calculs, nous prendrons 21% pour O2 et 79% pour N2.
2) DÉFINITION
La loi de DALTON nous dit :
|
A TEMPÉRATURE CONSTANTE DONNÉE, LA PRESSION D'UN MÉLANGE GAZEUX EST ÉGALE A LA SOMMES DES PRESSIONS QU'AURAIT CHACUN DES GAZ S'IL OCCUPAIT SEUL LE VOLUME TOTAL. |
3) EXPLICATION
Essayons de comprendre en prenant un exemple :
Un plongeur respire de l'air comprimé à une profondeur de 40 m. L'air est donc respiré à la pression qu'il subit, soit 5bars. Cet air est composé de 21% O2 et de 79% N2.
Si l'O2 était seul, il occuperait toute la place et aurait une pression de 5 bars. Mais comme il n'occupe que 21% du volume total, sa pression est de 21/100 de la pression du mélange. Cette pression que l'on appelle pression partielle (P.P.) est donc de :
(21/100) x 5 = 1,05b.
De même, si l'azote était seul, il occuperait toute la place et aurait une pression de 5 bars. Mais, comme il n'occupe que 79% du volume total, sa pression est de 79/100 de la pression du mélange.
(79/100) x 5 = 3,95b.
|
PpO2 = 1,05b soit 21% |
|
PpN2 = 3,95b soit 79% |
Nous constatons que la somme de ces deux pressions partielles (1,05 + 3,95) est égale à 5 bars, qui est la pression absolue du mélange.
Nous voyons donc que pour calculer la Pp d'un gaz, il suffit de multiplier la concentration de ce gaz, soit son pourcentage, par la pression absolue (Pabs) du mélange.
Pp = (X/100) x Pabs.
et inversement
Pabs = Pp x (100/X).
3) DALTON ET LA PLONGÉE
Beaucoup de gaz sont toxiques pour l'organisme. Mais cela dépend de sa nature et de sa Pp.
Nous savons qu'entre 4 et 5,6b de Pp, l'azote à des effets narcotiques appelés ivresse des profondeurs. Pour calculer la Pabs, il suffit de se référer à la formule du dessus.. A savoir que la profondeur varie suivant les individus.
Pour O2, une Pp inférieure à 0,17b est insuffisante et provoque l'anoxie, voire syncope. A l'inverse, une Pp > à 1,6 b entraîne des convulsions qui apparaissent plus ou moins vite en fonction de la pression du gaz (hypéroxie).
Le gaz carbonique est toxique à partir d'une Pp de 0,03 bar.
Pour éviter ces problèmes de toxicité, certains plongeurs utilisent des mélanges enrichis en oxygène ou des compositions remplaçant, par exemple, l'azote par l'hélium.
![]()
 |
1) INTRODUCTION
Le physicien et chimiste anglais William HENRY (1765-1836) a défini en 1803, la loi sur la dissolution des gaz dans les liquides. Celui-ci a démontré que la quantité de gaz dissous dans un liquide augmentait avec la pression.
L'organisme d'un plongeur, qui respire de l'air sous pression, dissout certains gaz de ce mélange qui croît avec la profondeur, du fait de l'augmentation de la pression.
Exemple : Si vous débouchez une bouteille de boisson gazeuse, il se produit un dégagement de bulles au moment de l'ouverture. Cela signifie que le liquide contenait un gaz ayant une pression supérieur à celle du milieu ambiant.
2) DÉFINITION
Après plusieurs expériences, HENRY a énoncé cette loi :
|
A TEMPÉRATURE DONNE ET A SATURATION, LA QUANTITÉ DE GAZ DISSOUS DANS UN LIQUIDE EST PROPORTIONNELLE A LA PRESSION EXERCÉE PAR CE GAZ SUR LE LIQUIDE. |
Cette loi très important pour les plongeurs est à l'origine des accidents de décompression .
En pratique, cette dissolution intéresse toutes les parties du corps. Mais la quantité de gaz absorbé par le liquide et la vitesse de dissolution dépendent de plusieurs facteurs :
LA PRESSION : Plus elle augmente, plus la quantité de gaz dissous est importante.
LA DURÉE D'EXPOSITION : La dissolution n'est pas instantanée. Plus le gaz reste en contact avec un liquide, plus il se dissout.
LA SURFACE DE CONTACT : Plus la surface est grande, plus la dissolution est importante.
LA TEMPÉRATURE : Plus la température s'élève, plus la quantité de gaz dissous diminue et inversement.
LA NATURE DU LIQUIDE : Le corps humain est constitué de plusieurs liquides pour lesquels la vitesse de dissolution et la solubilité des gaz sont différentes.
LA NATURE DU GAZ : Plus le coefficient de solubilité du gaz est élevé, plus la quantité de gaz dissous est importante à la pression constante.
L'AGITATION : Le renouvellement du liquide au contact du gaz accélère la vitesse de dissolution.
3) LES DIFFERENTS ETATS DE SATURATION AU COURS D'UNE PLONGEE.
Pour éviter la confusion des termes avec la pression exercée sur le liquide, on utilise le terme de TENSION pour le gaz dissous. la tension sert à évaluer la quantité de gaz en solution.
En fonction de la quantité de gaz que contient un liquide, il existe 3 états différents :
LA SATURATION : La quantité N2 qui entre dans le liquide est égale à celle qui en sort. Le bilan des échanges est nul.
LA SOUS-SATURATION : un liquide est dit sous-saturé lorsque la tension du gaz dissous (p) est inférieure à la pression du gaz libre (P). On peut écrire p<P. A savoir qu'un liquide sous-saturé tend toujours vers un état d'équilibre (saturation) en absorbant du gaz.
LA SURSATURATION : un liquide est dit sursaturé quand la tension du gaz dissous(p) est suéprieure à la pression du gaz libre(P). on peut écrire p>P. un liquide sursaturé tend vers l'équilibre en restituant du gaz (voir dessin ci-dessous).
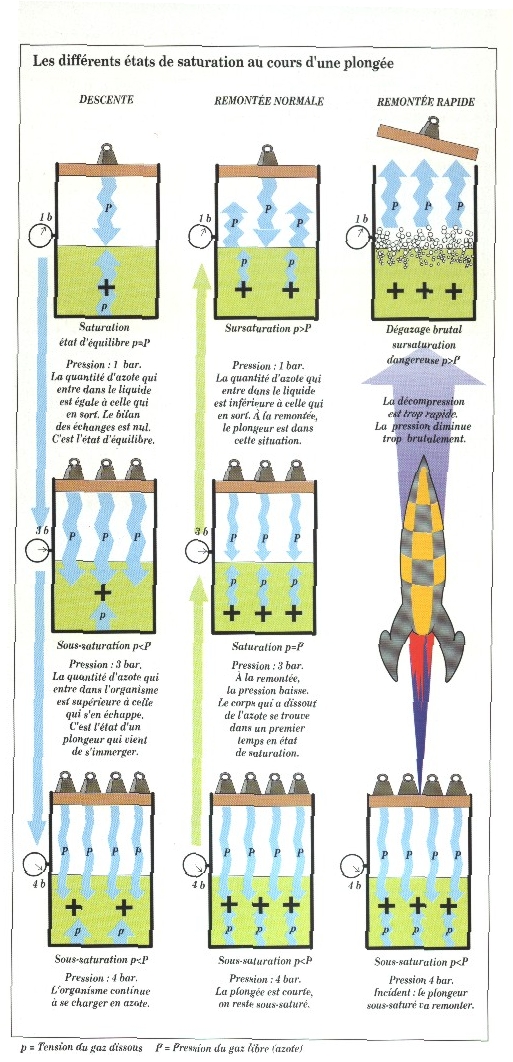
Les trois états que nous venons de détailler se rencontrent successivement au cours d'une plongée.
Il esxiste un autre état : LA SURSATURATION CRITIQUE : C'est la pression du gaz libre qui diminue brutalement. Donc, les molécules de gaz dissoutes dans le liquide remontent rapidement vers la surface (champagne par exemple). Il peut arriver que le dégazage soit si brutal qu'il y ait formation importante de bulles au sein du liquide.
4) LA PRESSION DU TEMPS
La dissolution d'un gaz dans un liquide ne suit pas une progression constante. Rapide au début, elle va ralentir d'autant plus que l'on se rapproche de l'état d'équilibre. Pour la désaturation, le processus s'inverse dans les mêmes proportions.
Le corps humain est constitué de différents tissus (musculaire, sanguin, etc.) aux fonctions particulières. Mais les cellules qui les composent ont un point commun : elles baignent dans un liquide. Les cellules vont se comporter comme des liquides face àl'air comprimé que nous repirons en plongée. ils sont capables de dissoudre des gaz à des vitesses différentes.
Afin de caractériser les temps d'absorption, on a défini une valeur conventionnelle appelée "PERIODE" (temps nécessaire pour obtenir la moité de saturation). Elle est exprimé en minute.
Dans l'exemple ci-dessous, si Q est la quantité nécessaire pour saturer un liquide, la période est le temps qu'il faut pour obtenir Q/2.
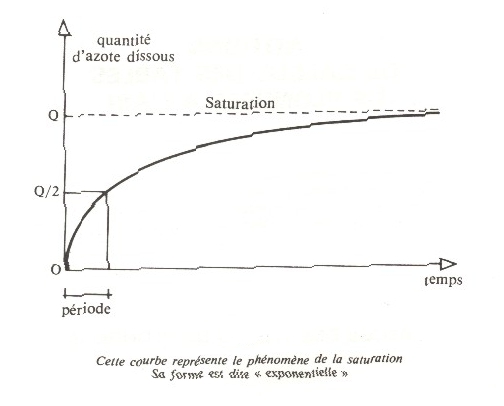
5) HENRY ET LA PLONGEE
La loi de HENRY trouve sont application dans le calcul des tables de plongée en faisant intervenir les notions de périodes et de tissus. Le coefficient de sursaturationcritique permet de définir la prfondeur des paliers.
Le phénomène de dégazage avec formation anarchique de bulles se traduit en plongée par un accident de décompresseur.